Notre rencontre avec le Pr Philippe Grenier et le Dr François Mellot, chef du service de radiologie, débute par un petit cours théorique sur les concepts au cœur de l’intelligence artificielle, et plus particulièrement le Deep learning, sorte de sous-domaine du Machine learning[voir encadré – NDLR]. L’imagerie médicale, où les données sont de longue date numérisées et standardisées, est une spécialité qui s’est rapidement saisie des promesses de l’IA, comme en témoignent la profusion d’applications testées partout dans le monde et les très nombreuses publications scientifiques. Le potentiel de cette technologie est aujourd’hui majeur pour libérer les radiologues de tâches très fastidieuses grâce au Machine Learning, mais aussi, de plus en plus, pour détecter des signes radiologiques significatifs mais parfois difficilement perceptibles par l’œil humain. C’est là qu’entre en jeu le Deep learning. « Nous utilisons pour cela des réseaux de neurones dits convolutionnels, c’est-à-dire constitués par plusieurs couches de neurones artificiels fortement interconnectés : chaque neurone d’une couche est relié à l’ensemble des neurones de la couche suivante, sur le modèle du cerveau humain. La puissance de calcul est telle qu’il est possible d’effectuer en volume plusieurs tâches complexes et d’obtenir des résultats bien plus rapidement que si un radiologue s’en était chargé manuellement », précise le Pr Grenier.
Des solutions utilisées en routine aux urgences
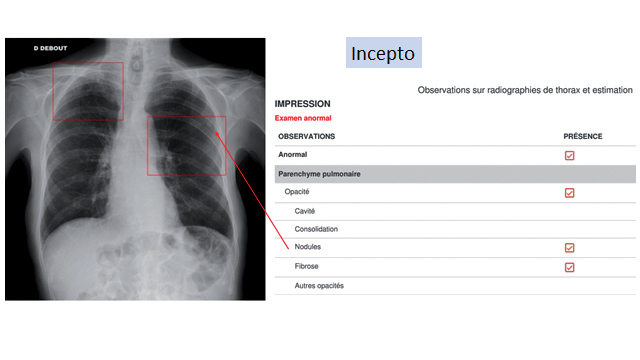
Les premières incursions de l’hôpital Foch dans le domaine de l’IA ont eu lieu pour répondre à la demande des radiologues eux-mêmes, comme nous l’explique le Dr Mellot : « Avec le développement de l’imagerie en coupe, le nombre d’image à analyser a augmenté de manière exponentielle, ce qui mobilisait fortement les radiologues alors même qu’il s’agit d’une spécialité sous tension. Nous avons donc cherché des solutions pour faciliter l’interprétation des images réalisées pour les urgentistes, en particulier les radiographies du thorax et des extrémités osseuses ». Encore fallait-il trouver la perle rare. En effet, pour la radiographie du thorax, la plupart des modèles disponibles sur le marché sont mono-pathologie, par exemple centrés sur la tuberculose. Or une solution utilisée dans un contexte d’urgences hospitalières se devait d’être généraliste. « Nous avons finalement trouvé une plateforme proposant plusieurs applications capables de détecter automatiquement les anomalies thoraciques les plus fréquentes – pneumothorax, nodule, infection pulmonaire ou bronchiolaire, etc. Les urgentistes ne sont en effet pas toujours en mesure de le faire eux-mêmes, puisqu’il faut ici une formation spécifique. L’IA facilitedonc l’identification des cas potentiellement problématiques, qu’un scanner permettra éventuellement de confirmer », détaille le Pr Grenier.
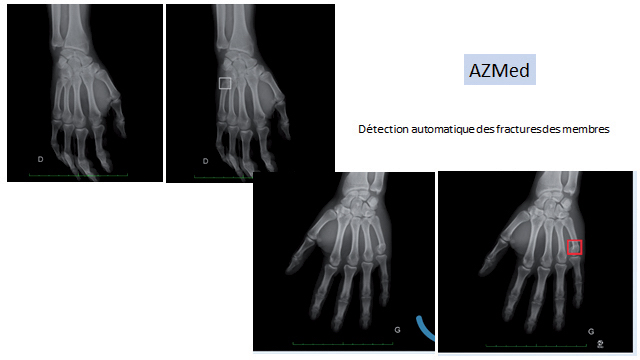
La même plateforme a rapidement été utilisée pour détecter également les fractures des membres inférieurs et supérieurs, qui rythment le quotidien des services d’urgence. Ces solutions, désormais utilisées en routine, se distinguent par un temps de lecture compris entre une et trois secondes, une fois l’image transmise au PACS de l’établissement. Les radiographies où aucune anomalie n’a été détectée font toutefois encore l’objet d’une double lecture, le temps de mettre en place une étude sur les valeurs prédictives négatives du logiciel, suspendue pour cause de crise épidémique. « Il nous faut, concrètement, analyser la capacité diagnostique du logiciel, et donc quantifier son taux de précision. Chaque image identifiée comme ‘normale’ sera soumise à deux ou trois radiologues pour voir si les résultats concordent. Avec une valeur prédictive négative supérieure à 98 %, nous pourrons suspendre la double lecture et nous appuyer à 100 % sur le logiciel pour la lecture des radios normales », ajoute-t-il.
La même plateforme a rapidement été utilisée pour détecter également les fractures des membres inférieurs et supérieurs, qui rythment le quotidien des services d’urgence. Ces solutions, désormais utilisées en routine, se distinguent par un temps de lecture compris entre une et trois secondes, une fois l’image transmise au PACS de l’établissement. Les radiographies où aucune anomalie n’a été détectée font toutefois encore l’objet d’une double lecture, le temps de mettre en place une étude sur les valeurs prédictives négatives du logiciel, suspendue pour cause de crise épidémique. « Il nous faut, concrètement, analyser la capacité diagnostique du logiciel, et donc quantifier son taux de précision. Chaque image identifiée comme ‘normale’ sera soumise à deux ou trois radiologues pour voir si les résultats concordent. Avec une valeur prédictive négative supérieure à 98 %, nous pourrons suspendre la double lecture et nous appuyer à 100 % sur le logiciel pour la lecture des radios normales », ajoute-t-il.
Covid-19 : un algorithme pour le suivi des lésions pulmonaires
Toujours sur le plan thoracique, et alors que l’épidémie due au nouveau coronavirus battait son plein, le service d’imagerie médicale de l’hôpital Foch a été l’un des quelques établissements sollicités à travers le monde pour participer à la mise au point d’un logiciel permettant de quantifier automatiquement la sévérité des lésions pulmonaires associées au Covid-19. « L’un des leaders du secteur, avec lequel nous travaillions déjà, nous a demandé de lui fournir des scanners pulmonaires effectués chez des patients Covid+. Nous avons été en mesure de lui communiquer 200 examens scanners présentant des opacités en verre dépoli focales périphériques ou multifocales, et des opacités de condensation, qui ont contribué au développement d’un algorithme enrichi par l’intelligence artificielle », raconte le Dr Mellot. Concrètement, la solution effectue une segmentation volumique (ou 3D) des poumons, des lobes et des zones lésées pour produire deux mesures combinées : l’étendue des anomalies Covid-19 et la présence de fortes opacités (condensations).
Ces résultats peuvent ensuite être utilisés pour analyser la gravité de l’atteinte des poumons et des lobes, mais aussi et surtout pour surveiller la progression des anomalies, de manière à mettre en œuvre un suivi longitudinal véritablement pertinent. « Même s’il ne peut pas encore être utilisé en routine faute de marquage CE, ce logiciel n’en permet pas moins de réaliser des études cliniques pour mieux comprendre l’évolution des lésions et adapter le suivi des patients, aujourd’hui contrôlés deux mois puis quatre mois après leur sortie. Nous avons déjà démontré qu’effectuée visuellement, la progression des lésions était légèrement surestimée par rapport à celle de l’algorithme, qui nous permet donc de gagner en précision. Nous comptons désormais l’utiliser pour le suivi des 130 patients Covid+ hospitalisés à Foch », note le Pr Grenier.
Ces résultats peuvent ensuite être utilisés pour analyser la gravité de l’atteinte des poumons et des lobes, mais aussi et surtout pour surveiller la progression des anomalies, de manière à mettre en œuvre un suivi longitudinal véritablement pertinent. « Même s’il ne peut pas encore être utilisé en routine faute de marquage CE, ce logiciel n’en permet pas moins de réaliser des études cliniques pour mieux comprendre l’évolution des lésions et adapter le suivi des patients, aujourd’hui contrôlés deux mois puis quatre mois après leur sortie. Nous avons déjà démontré qu’effectuée visuellement, la progression des lésions était légèrement surestimée par rapport à celle de l’algorithme, qui nous permet donc de gagner en précision. Nous comptons désormais l’utiliser pour le suivi des 130 patients Covid+ hospitalisés à Foch », note le Pr Grenier.
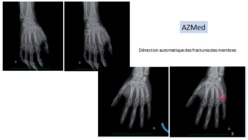
La même plateforme est utilisée pour détecter également les fractures des membres inférieurs et supérieurs. ©AZMed
Six tâches et un compte-rendu complet en 17 minutes seulement
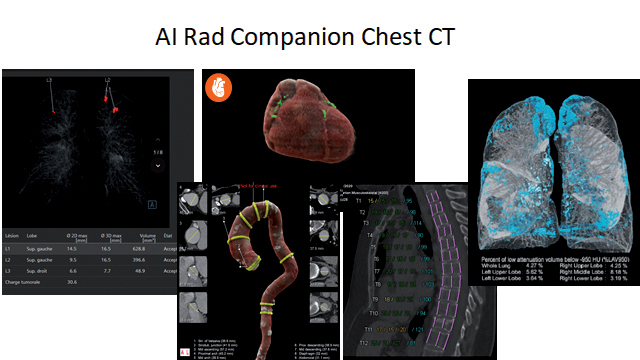
Cette approche, qui fait la part belle à la médecine de précision, représente la deuxième application concrète du partenariat noué début 2019 entre l’hôpital Foch et un constructeur majeur du marché autour, justement, de l’utilisation des technologies d’intelligence artificielle en imagerie médicale. « Nous sommes le tout premier établissement de santé français à nous être équipés d’une solutionparticulièrement novatrice, qui permet, en un clic, de détecter automatiquement les différents organes du thorax et les signes radiologiques d’une éventuelle pathologie : une fois les images du thorax acquises grâce au scanner, elles sont reconstruites en 3D et envoyées sur le cloud pour être analysées par plusieurs logiciels d’IA. Au bout de 17 minutes environ, le radiologue reçoit toutes les informations sur sa station de travail », sourit Philippe Grenier.
Cette solution véritablement révolutionnaire peut ainsi effectuer six tâches simultanément : (1) la segmentation des poumons, associée à la mesure du volume des lobes, (2) la détection des lésions pulmonaires, en particulier les nodules potentiellement évocateurs d’un cancer, (3) la quantification de l’emphysème pulmonaire, une maladie des voies aériennes caractérisée par la destruction de la paroi alvéolaire, (4) la segmentation automatique du cœur, afin de détecter et de quantifier en volume les calcifications coronaires, marqueurs du risque d’accident cardiaque, (5) la segmentation de l’aorte thoracique, pour analyser les calcifications et les dilatations segmentaires, qui constituent des menaces potentielles d’anévrisme, (6) et enfin la segmentation des vertèbres dorsales avec la mesure de la hauteur individuelle de chaque corps, en particulier pour analyser la densité des vertèbres marqueurs d’ostéoporose. Elle fournit ensuite une visualisation synthétique avec les images clés des différentes fonctions, et des tableaux de toutes les mesures intégrées par la suite dans le dossier médical du patient. « Ce logiciel est aujourd’hui utilisé à des fins de dépistage chez les patients de plus de 50 ans disposant d’une prescription pour un scanner thoracique : il permet de détecter certaines anomalies afin de mettre en place la surveillance adéquate – ou d’initier la prise en charge thérapeutique. Mais il pourrait également être un outil opportuniste pour l’évaluation de plusieurs risques – cancers pulmonaires, accidents cardiaques, anévrismes, ostéoporose – par exemple dans le cadre d’opérations de dépistage à grande échelle », poursuit-il.
Cette solution véritablement révolutionnaire peut ainsi effectuer six tâches simultanément : (1) la segmentation des poumons, associée à la mesure du volume des lobes, (2) la détection des lésions pulmonaires, en particulier les nodules potentiellement évocateurs d’un cancer, (3) la quantification de l’emphysème pulmonaire, une maladie des voies aériennes caractérisée par la destruction de la paroi alvéolaire, (4) la segmentation automatique du cœur, afin de détecter et de quantifier en volume les calcifications coronaires, marqueurs du risque d’accident cardiaque, (5) la segmentation de l’aorte thoracique, pour analyser les calcifications et les dilatations segmentaires, qui constituent des menaces potentielles d’anévrisme, (6) et enfin la segmentation des vertèbres dorsales avec la mesure de la hauteur individuelle de chaque corps, en particulier pour analyser la densité des vertèbres marqueurs d’ostéoporose. Elle fournit ensuite une visualisation synthétique avec les images clés des différentes fonctions, et des tableaux de toutes les mesures intégrées par la suite dans le dossier médical du patient. « Ce logiciel est aujourd’hui utilisé à des fins de dépistage chez les patients de plus de 50 ans disposant d’une prescription pour un scanner thoracique : il permet de détecter certaines anomalies afin de mettre en place la surveillance adéquate – ou d’initier la prise en charge thérapeutique. Mais il pourrait également être un outil opportuniste pour l’évaluation de plusieurs risques – cancers pulmonaires, accidents cardiaques, anévrismes, ostéoporose – par exemple dans le cadre d’opérations de dépistage à grande échelle », poursuit-il.
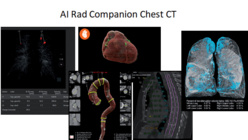
Détection automatique des lésions pulmonaires et segmentation du cœur, de l'aorte thoracique, des vertèbres dorsales et des poumons. ©Siemens
À terme, une médecine prédictive et personnalisée
L’image du “radiologue augmenté” prend ici tout son sens puisque, comme nous l’explique François Mellot, « certaines mesures peuvent difficilement être effectuées par le radiologue, par exemple pour quantifier un emphysème. L’IA le libère donc de tâches fastidieuses, mais lui permet aussi d’aller plus loin ». Pour cette même raison, son potentiel applicatif va au-delà du dépistage ou du diagnostic : l’intelligence artificielle peut également être utilisée à des fins pronostiques ou pour préciser le choix thérapeutique. « La technologie permet d’effectuer des calculs très complexes sur la base de données imperceptibles à l’œil nu, par exemple pour réaliser des analyses de textures. C’est d’ailleurs aujourd’hui un champ prometteur de la recherche clinique en oncologie, puisque nous pourrions alors mieux savoir comment évoluerait une tumeur. Au-delà de la médecine de précision, nous pourrons alors prendre le virage d’une médecine prédictive personnalisée », note le Pr Grenier.
L’hôpital Foch a déjà identifié ici un axe de recherche en urologie, en particulier pour les cancers de la vessie en partenariat avec le Centre René Huguenin, l’antenne de l’Institut Curie (CLCC) située à Saint-Cloud. Il compte également développer l’utilisation des technologies IA en neurologie, et plus globalement pour les pathologies neuro-vasculaires, mais aussi en pneumologie : en tant que premier centre de transplantations pulmonaires en France, il souhaite en effet mettre au point un outil IA d’analyse des images pour prédire précocement la survenue de rejets. « Nous avons de nombreux autres projets, par exemple pour élargir l’IA à d’autres modalités comme les mammographies en 2021 », ajoute-t-il. En tout état de cause, l’avenir semble être bel et bien être en train de s’écrire à l’hôpital Foch.
Article publié sur le numéro de septembre d'Hospitalia à consulter ici.
L’hôpital Foch a déjà identifié ici un axe de recherche en urologie, en particulier pour les cancers de la vessie en partenariat avec le Centre René Huguenin, l’antenne de l’Institut Curie (CLCC) située à Saint-Cloud. Il compte également développer l’utilisation des technologies IA en neurologie, et plus globalement pour les pathologies neuro-vasculaires, mais aussi en pneumologie : en tant que premier centre de transplantations pulmonaires en France, il souhaite en effet mettre au point un outil IA d’analyse des images pour prédire précocement la survenue de rejets. « Nous avons de nombreux autres projets, par exemple pour élargir l’IA à d’autres modalités comme les mammographies en 2021 », ajoute-t-il. En tout état de cause, l’avenir semble être bel et bien être en train de s’écrire à l’hôpital Foch.
Article publié sur le numéro de septembre d'Hospitalia à consulter ici.
Machine learning v/s Deep learning
L’intelligence artificielle est rendue possible par deux concepts, qui utilisent deux méthodes bien distinctes : le Machine learning, ou apprentissage autonome, et le Deep learning, ou apprentissage profond.
Le Machine learningdésigne un système apprenant basé sur l’utilisation de grands ensembles de données structurées et catégorisées, qui lui permettent de comprendre comment classer de nouvelles données similaires. L’algorithme adapte lui-même le système à partir des retours faits par le développeur. Cette technologie, qui est la plus ancienne des deux, est pour l’essentiel utilisée pour la réalisation de tâches simples en routine.
Apparu il y a une dizaine d’années, le Deep learningn’a pour sa part pas besoin de données structurées : fonctionnant à partir de plusieurs couches de réseaux neuronaux qui combinent différents algorithmes en s’inspirant du cerveau humain, le système identifie lui-même les caractéristiques discriminantes des données sans avoir besoin d’un entraînement préalable. Ilest à ce titre pertinent pour la réalisation de tâches complexes mais est aussi plus gourmand : plus de 100 millions d’entrées sont nécessaires pour donner des résultats fiables.
Source : ionos.fr
Le Machine learningdésigne un système apprenant basé sur l’utilisation de grands ensembles de données structurées et catégorisées, qui lui permettent de comprendre comment classer de nouvelles données similaires. L’algorithme adapte lui-même le système à partir des retours faits par le développeur. Cette technologie, qui est la plus ancienne des deux, est pour l’essentiel utilisée pour la réalisation de tâches simples en routine.
Apparu il y a une dizaine d’années, le Deep learningn’a pour sa part pas besoin de données structurées : fonctionnant à partir de plusieurs couches de réseaux neuronaux qui combinent différents algorithmes en s’inspirant du cerveau humain, le système identifie lui-même les caractéristiques discriminantes des données sans avoir besoin d’un entraînement préalable. Ilest à ce titre pertinent pour la réalisation de tâches complexes mais est aussi plus gourmand : plus de 100 millions d’entrées sont nécessaires pour donner des résultats fiables.
Source : ionos.fr